ポリグルタミン病とは
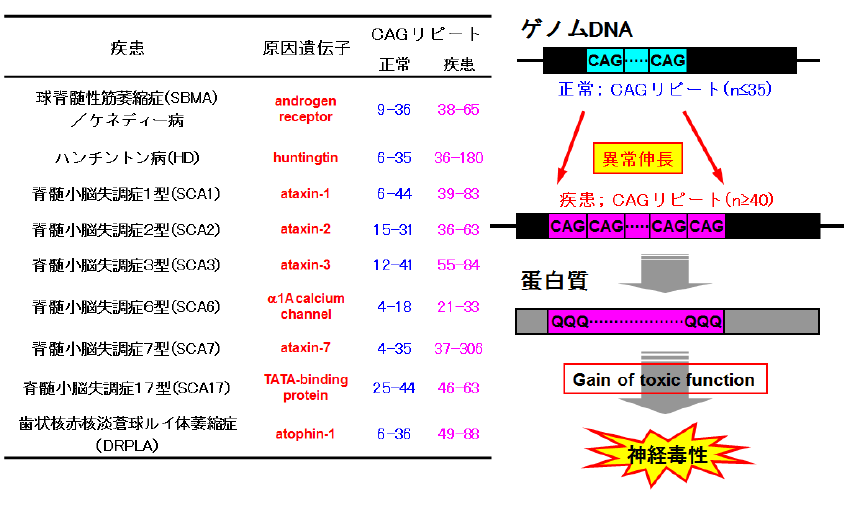
ポリグルタミン病(PolyQ病)は、ハンチントン病や脊髄小脳失調症(SCA)、球脊髄性筋萎縮症など、9つの遺伝性疾患の総称です。脳や脊髄などの特定の領域の神経細胞が徐々に脱落し、物忘れや手足が勝手に動いてしまう(舞踏運動)、手足のふるえ、歩行時のふらつき、手足の力が入らないなど、疾患特有の症状が徐々に進行していくことが知られています。残念ながら疾患の進行を止める根本治療法はまだ確立していません。 ポリグルタミン病は、それぞれ異なる遺伝子内にあるCAGの繰り返し配列(CAGリピート)回数が健常人より異常に伸長するという遺伝子変異が原因となる遺伝性疾患です。このCAG配列は、グルタミンというアミノ酸(一文字表記ではQと表す)を作るため、異常伸長したポリグルタミン鎖を持つタンパク質(PolyQタンパク質)が生成されます。異常PolyQタンパク質は、神経細胞内で凝集し、蓄積することにより、神経変性を引き起こすと考えられています。このことから、私たちはタンパク質の凝集過程に注目して、PolyQ病の発症機序解明と治療法開発研究を進めています。
ポリグルタミン病の発症機序の解明
ポリグルタミン病の発症機序を解明するためには、異常PolyQタンパク質がどのようにして凝集し、細胞毒性を発揮するのかという基礎的な理解が必要です。私たちは、異常伸長したPolyQ配列を持つ疾患モデルタンパク質を用い、PolyQタンパク質の凝集過程を試験管内で再現する実験系を確立しています(J Biol Chem 2000, US patent)。
この実験系を利用して、PolyQタンパク質の凝集過程を生化学的・構造生物学的に解析した結果、PolyQタンパク質は凝集する前の単量体の状態でβシート構造と呼ばれる異常構造へと変化すること、そしてβシート変移した単量体PolyQタンパク質こそが毒性を発揮する構造体であることを明らかにしました(Nat Struct Mol Biol 2007)。
この成果により、異常タンパク質のβシート変移が、PolyQ病をはじめとするさまざまな神経変性疾患の治療標的となる可能性が明らかとなり、治療薬開発の道筋が示されました。現在、PolyQタンパク質だけでなく、他の神経変性疾患の原因タンパク質についても、その凝集過程についてさらなる詳細な解析を進めています。
また、当研究室ではショウジョウバエやマウス、マーモセットなど、多彩なPolyQ病動物モデルを樹立・保有し、PolyQ病の発症機序の解明を進めています。例えば脊髄小脳失調症1型ノックインマウスの解析からは、シナプス形成不全などの神経細胞の機能障害が、すでに運動症状が現れる前の時点から確認され、早期の治療介入の重要性が明らかとなりました(Sci Rep 2015)。
また、最近、世界初のPolyQ病霊長類モデルとして、脊髄小脳失調症3型モデルマーモセットを樹立し、報告しました(eNeuro 2017)。マーモセットは、マウスなどのげっ歯類と比べて、脳の構造や薬物代謝などの点において、ヒトにより近い特徴を有しており、発症機序の解明のみならず、治療法開発に向けたさらなる研究の進展が期待されます。
ポリグルタミンタンパク質の凝集抑制による治療薬の開発
PolyQ病および多くの神経変性疾患において、タンパク質の異常凝集、特にβシート構造変移を抑制することが治療に有効と考えられます。そこで私たちは、ファージディスプレイ法により、PolyQタンパク質の凝集を抑制するペプチドQBP1を開発しました(J Biol Chem 2000)。QBP1は、PolyQタンパク質のβシート変移を抑制すること(Nat Struct Mol Biol 2007)、PolyQ病モデルショウジョウバエに対して高い治療効果を示すことから(Hum Mol Genet 2003, Mol Ther 2007)、PolyQ病の根本を抑える有望な治療候補薬と考えられます。現在、QBP1をもとにPolyQ病治療薬の開発を進めています(Bioorg Med Chem 2009)。
また、低分子化合物ライブラリーを用いた大規模スクリーニングにより、PolyQタンパク質に対する凝集阻害化合物を多数同定しており、このうち一部の化合物についてはすでにPolyQ病モデルショウジョウバエに対する治療効果を確認しています。さらにそのうちの1種(QAI1)は、PolyQタンパク質のβシート変移を抑制すること、PolyQ病モデルマウスに対する治療効果を示すこと(BRAIN 2020, 特許出願済)、および既存薬であることから、現在医師主導治験を行っています。
一方、上記の治療薬開発と並行し、治療候補分子を脳内に送達する手法の開発も進めています。脳と末梢組織の間には、血液脳関門(Blood-Brain Barrier, BBB)と呼ばれる障壁が存在し、血流を介した脳内への物質輸送が厳密に制限されています。例えば、一部の脂溶性薬物を除き、ほぼすべての水溶性薬物やタンパク質などは、末梢組織に投与しても脳内にほとんど移行しないことが知られています。そのため、薬理活性を有する治療候補分子をいかにして脳内に送達させるかが脳疾患に対する創薬開発の大きな課題となっています。私たちは、血液脳関門を通過し、脳内に効率よく移行する分子をすでに同定しており(特許出願済)、これを脳移行性キャリア分子として応用することで汎用的な脳内薬物送達法を開発しています。
タンパク質の凝集・蓄積を抑える生体内防御システムの解明と治療薬開発
ミスフォールディングや凝集といった、タンパク質の構造異常は、PolyQタンパク質や神経変性疾患の原因タンパク質だけに見られる現象ではなく、私たちの体の中では日常的に起こっています。にもかかわらず、神経細胞が変性したり、病気になったりしないのは、生体が異常構造のタンパク質を取り除くための特別な仕組み(タンパク質の品質管理機構)を備えているからです。例えば分子シャペロンという防御因子は、異常構造のタンパク質を正しい構造へと戻す働きをしますし、オートファジーやユビキチン・プロテアソーム分解系は異常タンパク質を分解除去し、細胞内に凝集物が蓄積するのを防ぐことが知られています。
私たちは分子シャペロンやオートファジー分解系などの生体内防御機構がどのようにタンパク質の凝集を抑制し、PolyQ病や神経変性疾患の進行を抑えているかについて基礎的な研究を進めています(J Biol Chem 2015, Proc Natl Acad Sci USA 2015)。また、基礎研究から得られた成果を発展させ、この生体内機構の活性化による治療法の開発も進めています(J Biol Chem 2008, Nat Biotechnol 2010, PLoS One 2012)。
特に、最近私たちは、分子シャペロンがエクソソームと呼ばれる細胞外小胞によって細胞間を伝播し遠隔組織でタンパク質凝集を抑制することを発見しました(下図)(Proc Natl Acad Sci USA 2015)。これは、タンパク質凝集に対して細胞同士が助け合って神経変性を抑制するという仕組みが生体内に存在することを示唆しており、現在、その詳細な機序解明を進めるとともに、エクソソームに注目した神経変性疾患の診断法・治療法の開発を進めています。