研究紹介
伊藤彰彦教授グループ
ヒトの病変(病理組織標本)を分子レベルで解析する実験病理学的な研究を展開しています。病変構成細胞における遺伝子発現、及び蛋白発現にどのような異常があるのかについて、分子・細胞生物学的な手法を駆使してその実態解明を行っています。病変内には、生理的には見られないような様々な細胞(腫瘍細胞や炎症細胞も含めて)が存在しています。それらの細胞について、従来の病理学は、”腫瘍性”、”反応性”、”再生性”、”変性” といった言葉を当てて説明してきましたが、その実態は全くと言ってよい程何もわかっていません。当研究室では、病変特異的に出現する細胞の由来は何なのか、病変内の他の細胞や細胞外基質との間でどのような相互作用を行っているのか、その結果としてどのような病態が生じているのか、に興味の中心があります。まさに、病理学の真髄を堪能しつつ、病理学の更なる発展を期する研究的アプローチです。
最近では主に、様々な病変内で接着分子に発現の異常(転写レベル、及び転写後調節レベルで)があり、その異常が疾患固有の病態形成と密接に関連しているという実態を明らかにしつつあります。それらの成果を基に、”接着分子病””という概念の樹立を目指しています。
以下にこれまでの研究経緯と今後の展望を紹介します。
- アトピー性皮膚炎におけるCADM1の機能解析
- 過敏性大腸炎における神経-マスト細胞-平滑筋相互作用
- 癌細胞・白血球の浸潤・遊走を司るeffector分子の同定
- 細胞間接着の力学的測定法の開発とその応用
神経免疫相互作用を増強する接着分子SgIGSF/TSLC1/CADM1
― ストレスと症状増悪の関連を説明する?
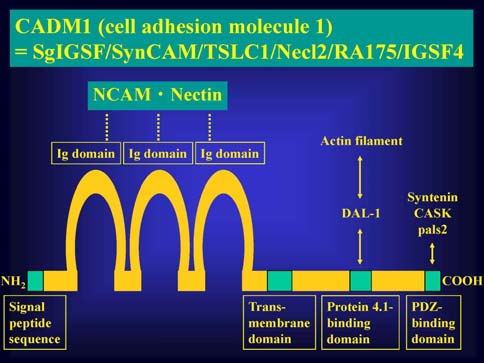
1995年頃よりmicrophthalmia転写因子(MITF)の実質的なnullミュータントであるtg/tgマウスにおけるマスト細胞欠損の原因解析を行ってきた。cDNAライブラリーのサブトラクション法により、tg/tgマウス由来培養マスト細胞における遺伝子発現異常を網羅的に調べている過程で、2003年に SgIGSF(spermatogenic immunoglobulin superfamily)を新規マスト細胞接着分子として単離した。細胞生物学的及び実験病理学的な解析の結果、(1)マスト細胞におけるSgIGSFの発現にはMITF転写因子が必須であること(即ち、tg/tgマウス由来培養マスト細胞はSgIGSFを発現していない)、(2)マスト細胞はこの分子を介して線維芽細胞に接着すること、(3)SgIGSFを介する接着はマスト細胞の生存に寄与すること、を明らかにした。
SgIGSFは細胞外に免疫グロブリン様ドメインを3つ、細胞内には細胞骨格系との連結に関わるコンセンサス・モチーフを複数持ち、構造的にはNCAM(neural cell adhesion molecule)やNectinと有意な相同性がある(図1)。興味深いことに我々の発見と丁度同じ頃、Biedererらのグループがこの分子の神経、特にシナプスにおける発現を同定した。彼らは、SgIGSFにはシナプス形成を誘導する機能があると報告し、SynCAM(synaptic cell adhesion molecule)と名付けた。(この分子には他にTSLC1、Necl2、RA175、IGSF4の別名がある。)
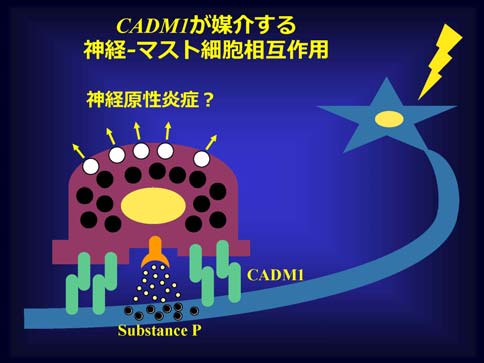
従って、SgIGSFはマスト細胞と神経細胞の両者に発現している接着分子である。神経-マスト細胞間の相互作用(神経-免疫クロストークの1つ)は古くから知られている。マスト細胞は骨髄造血幹細胞の子孫で、皮膚や消化管粘膜内に生理的に存在しており、しばしば神経線維と細胞膜-細胞膜の接点を成して分布する。また機能的には、神経から放出される神経伝達物質(特にサブスタンスP)がマスト細胞の活性化(特に脱顆粒)を引き起こすこと、逆に、マスト細胞から放出されるヒスタミン等のケミカルメディエイターやトリプターゼ等の蛋白分解酵素が神経細胞の脱分極活性に影響することなどが知られている。これらの事実はBienenstockやTheoharidesらによる精力的な一連の研究成果に基づくものであるが、しかしながら神経とマスト細胞との接着を直接支持・補強する分子的背景に関してはほとんど研究されて来なかった。SgIGSFはホモフィリックな結合様式を持つので、神経-マスト細胞間の解剖学的・機能的相互作用におけるキー分子となりうるのではないかと考え、in vitroで解析を行ったところ、この仮説を支持する結果を得た。すなわち、神経突起ネットワーク上でマスト細胞を共生培養しサソリ毒によって神経を特異的に脱分極させると神経と接着しているマスト細胞において細胞内カルシウム濃度の一過性上昇が惹起されるが、この応答には神経、マスト細胞の両者に発現するSgIGSFが重要な役割を担っていた。さらに、腸間膜を使ってin vivoでの検討も行った。腸間膜根部で腸間膜神経を電気的に刺激すると腸間膜マスト細胞は脱顆粒するが、この現象にはマスト細胞に発現するSgIGSFが重要な役割を担っていた。
神経の活性化が神経突起を介して遠隔或いは近傍の局所に炎症反応カスケードの進行を惹起する現象は、一般に神経原性炎症と呼ばれ、アトピー性皮膚炎、気管支喘息、円形脱毛症、片頭痛、過敏性腸症候群などの病態生理に関与していると考えられている。さらに、これらの疾患に限らず臨床の現場では精神的ストレスによって諸症状が悪化するということはしばしば経験されるが、そのような病態形成にも神経原性炎症の関与が疑われる。SgIGSFによって媒介される神経-マスト細胞間の機能的連関が神経原性炎症の進行に重要な役割を果たすことは容易に予想される(図2)。例えば、次のような可能性が今後の研究課題である。
- ストレスや炎症などの負荷が掛かると神経やマスト細胞におけるSgIGSF分子の発現・機能が増強するのではないか?
- その結果神経-マスト細胞間の機能的な相互作用が強まるのではないか?
- それが、様々な炎症性疾患や神経免疫関連疾患で経験されるストレス誘導性病態増悪の重要な分子的背景を成しているのではないか?
研究対象となる疾患としては、アトピー性皮膚炎、過敏性腸症候群、神経性禿症、気管支喘息を考えている。
なお、SgIGSFは2007年にCADM1(cell adhesion molecule 1)という名前に統合的に改名された。様々な別名の存在が本分子に対する研究の妨げになるとの判断に基づくものである。
接着分子の病態学:CADM1の発現異常によって惹起される種々の病態解析
― 細胞外ドメインshedding、及びalternative splicingの関与
2008年ころよりは、CADM1が関与する病態解析をより広い疾患群においても行っている。CADM1が生理的に胆管細胞や肺胞上皮細胞、膵島細胞に発現していることを同定したのを受けて、これらの細胞が関与する疾患群においてCADM1の発現がどうなっているのかを調べた。すると、肝硬変、肺気腫、糖尿病などにおいて、生理的な発現とは異なるCADM1の発現実態が明らかとなってきた。それらを踏まえて、現在CADM1の発現異常と病態形成との因果関係を詳細に解析中である。
肺気腫に関する研究成果はこちら。