近畿大学おおさかメディカルキャンパス臨床研究審査委員会について
― 目的と役割 ―
近畿大学おおさかメディカルキャンパス臨床研究審査委員会(KOMC-CRB)は、
臨床研究法(平成29年法律第16号)で定める臨床研究に係る審査意見業務を行います。
本委員会は、研究責任医師から研究の実施の適否等について意見を求められたときは、
臨床研究法に基づき、倫理的観点及び科学的観点から、研究機関及び研究者等の利益相反に関する
情報も含めて中立的かつ公正に審査意見業務を行い、文書により意見を述べます。
― 委員会概要 ―
委員会名称:近畿大学おおさかメディカルキャンパス臨床研究審査委員会
委員会略称:KOMC-CRB
委員会住所:大阪府堺市南区三原台1丁14番1号
設置名称:近畿大学病院
設置者:世耕 弘成(理事長)
設置住所:大阪府東大阪市小若江3丁目4番1号
認定日:令和7 年5 月28 日
認定番号:CRB5250001
*委員会の詳細については、以下をご参照ください。
認定臨床研究審査委員会申請・情報公開システム(jCRB)
― 規程・規程細則 ―
| CRB規程・規程細則(2025年8月29日改正) |
― 委員会名簿 ―
| 委員の構成要件の該当性 | 氏名 | 所属 |
| 医学又は医療の専門家 | 平瀬 主税 | 医師(近畿大学病院 臨床研究センター) |
| 医学又は医療の専門家 | 光冨 徹哉 | 医師(近畿大学医学部革新的医学講座・ 和泉市立総合医療センター) |
| 医学又は医療の専門家 | 田中 宏和 | 医師(近畿大学医学部 血液・膠原病内科学) |
| 医学又は医療の専門家 | 谷﨑 潤子 | 医師(近畿大学医学部 腫瘍内科学) |
| 医学又は医療の専門家 | 福岡 和也 | 医師(ベルランド総合病院包括的がん診療センター(腫瘍内科)) |
| 医学又は医療の専門家 | 加藤 有加 | 医師(国立病院機構 四国がんセンター 呼吸器内科) |
| 生命倫理に関する識見を有する者 | 岩江 荘介 | 教員(公立大学法人 宮崎県立看護大学) |
| 法律に関する専門家 | 国本 聡子 | 弁護士(澤上古谷総合法律事務所) |
| 一般の立場の者 | 奥野 弘明 | 会社員(株式会社 NTTデータ関西) |
| 一般の立場の者 | 岡野 倫子 | 管理栄養士(社会福祉法人和泉福祉会特別養護老人ホームひかりの園) |
(2025(令和7)年5月28日現在)
― 委員会議事録 ―
| 今年度の議事録 |
申請者の方へ
<新たにKOMC-CRB へ審査を依頼したい方へ>
KOMC-CRB で審査を依頼したい場合、下記の窓口までご連絡ください(学内外共通)。
| 近畿大学おおさかメディカルキャンパス臨床研究審査委員会(KOMC-CRB)事務局 メール:komc.crb@med.kindai.ac.jp |
<実施中の特定臨床研究に参加したい方へ>
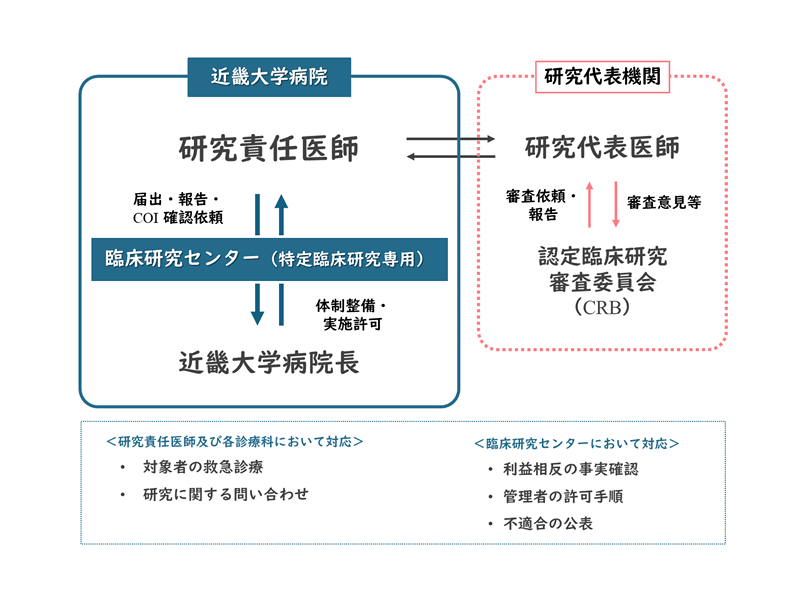
近畿大学病院で特定臨床研究を実施する際、研究責任医師は、近畿大学病院長の実施許可を得る手続きが必要となります(当院での審査は不要)。
下記の「届出書」および「添付資料一覧」をダウンロードしていただき、研究代表機関等から送付された、すべての資料と共に下記の窓口までご提出ください。
《届出の種類》
・新規(医薬品・医療機器・再生医療等製品)
・変更
・各種報告(定期・疾病等・重大な不適合・不具合・中止・終了)
| 近畿大学病院<特定臨床研究>担当窓口 メール:crb.jimu@med.kindai.ac.jp |
| 特定臨床研究に関する各種届出 | ||
| 届出書【近大-様式 特-1】 | 当院責任医師 → 病院長 | ダウンロード |
| 添付資料一覧 | 当院責任医師 → 病院長 | ダウンロード |
- 《注意》
・すべての受付は「メールのみ」となっております。
- ・お急ぎの場合、件名の冒頭に【至急】等を付してください。
- ・複数の診療科が参加する研究では、窓口を1 つとしていただけますと手続きが早くな
ります。
・近畿大学病院における管理者=「近畿大学病院 病院長」としてください。
・研究代表機関からの「CRB で承認された」旨の連絡のみで、研究を開始することはで
きません。必ず、病院長への届出をお願いします(届出を行わない場合、重大な不適合
に該当するおそれがあります)。
利益相反管理
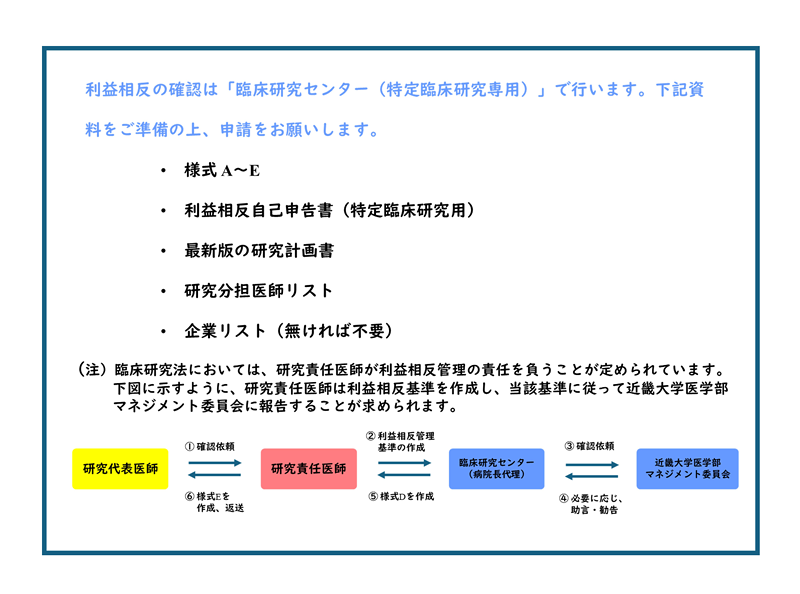
特定臨床研究では、利益相反(COI)の管理計画もCRBでの審査対象となります。
近畿大学病院で特定臨床研究を実施するすべての研究者は、以下の手順に従い、管理者による利益相反状況の事実確認を受けてください。
| 臨床研究法における利益相反管理について | |
| 標準業務手順書 ver.1.0 | ダウンロード |
| 利益相反管理の流れ(単施設) | ダウンロード |
| 利益相反管理の流れ(多施設共同) | ダウンロード |
《注意》
・利益相反管理計画は、すべての研究者について必要です。
・診療科内または研究者間で確認を行い作成された様式Dは、適切な事実確認を受けたことにはなりませんのでご注意ください。
各種報告
特定臨床研究の実施中または終了時に必要な手続きに関する説明がダウンロードできます。
実際の報告に必要な書式は、「書式一覧」からダウンロードしてください。
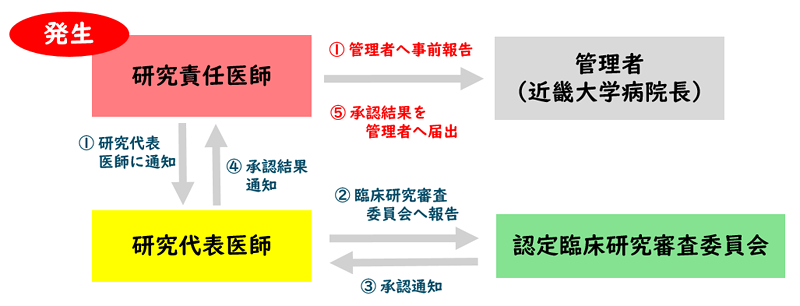
<疾病等・重大な不適合が発生した場合の報告>
近畿大学病院で研究実施計画書に定められた疾病等・重大な不適合が発生した場合、研究代表医師への通知及び近畿大学病院長への事前報告を実施してください。
| 各種報告 | |
| 定期報告:jRCT公表日から1年ごと | ダウンロード |
| 研究終了報告:研究が終了した時点 | ダウンロード |
| 中止報告:研究を中止した時点 | ダウンロード |
| 疾病等報告(医薬品) | |
| 疾病等又は不具合報告(医療機器・再生医療等製品) | |
| 重大な不適合に関する報告 |
|
《注意》
・「疾病等」とは、薬機法の副作用、医学系指針の有害事象と同義の用語です。
・「不適合」とは、法令・施行規則、研究プロトコール、手順書等の不遵守に加えて、研究データの改ざんや捏造を含む概念です。
書式一覧
特定臨床研究の手続きに必要な各種書式をダウンロードすることができます。なお、法令・施行規則等に伴い、書式が変更・改訂されることにご留意ください。
《研究者》
| (研究の開始まで) | |||
| 省令 様式第一 | 実施計画 | PI→地方厚生局 | ダウンロード |
| 省令 様式第一 | 実施計画(本学単独用) | PI→地方厚生局 | ダウンロード |
| 統一書式 1 | 研究分担医師リスト | PI→CRB | ダウンロード |
| 統一書式 2 | 新規審査依頼書 | PI→CRB | ダウンロード |
| 参考書式 2 | 要件確認書 (I:研究責任医師・II:実施医療機関) |
(PI→CRB) | ダウンロード |
| (近畿大学病院長への報告) | |||
| 重大な不適合報告書(近畿大学病院) | PI→近畿大学病院長 | ダウンロード | |
| 医薬品の疾病等報告書(近畿大学病院) | PI→近畿大学病院長 | ダウンロード | |
| 医療機器の疾病等又は不具合報告書(近畿大学病院) | PI→近畿大学病院長 | ダウンロード | |
| PI→近畿大学病院長 | |||
| (研究計画の変更) | |||
| 省令 様式第二 | 実施計画事項変更届書 | PI→地方厚生局 | ダウンロード |
| 統一書式 3 | 変更審査依頼書 | PI→CRB | ダウンロード |
| 省令 様式第三 | 実施計画事項軽微変更届書 | PI→地方厚生局 | ダウンロード |
| 統一書式 14 | 軽微変更通知書 | PI→CRB | ダウンロード |
| (定期報告) | |||
| 統一書式5 | 定期報告書 | PI→CRB | ダウンロード |
| 別紙様式3 | 定期報告書 | PI→地方厚生局 | ダウンロード |
| (不適合報告) | |||
| 統一書式7 | 重大な不適合報告書 | PI→CRB | ダウンロード |
| (疾病等報告) | |||
| 統一書式 8 | 医薬品の疾病等報告書 | PI→CRB | ダウンロード |
| 統一書式 9 | 医療機器の疾病等又は不具合報告書 | PI→CRB | ダウンロード |
| 統一書式 10 | 再生医療等製品の疾病等又は不具合報告書 | PI→CRB | ダウンロード |
| 別紙様式 2-1 | 疾病等報告書(医薬品) | PI→PMDA | ダウンロード |
| 別紙様式 2-2 | 疾病等報告書(医療機器) | PI→PMDA | ダウンロード |
| 詳細記載用書式 | 詳細記載用書式 | (PI→CRB) | ダウンロード |
| (研究の中止) | |||
| 統一書式11 | 中止通知書 | PI→CRB | ダウンロード |
| 省令様式 第四 | 特定臨床研究中止届書 | PI→地方厚生局 | ダウンロード |
| (研究の終了) | |||
| 統一書式12 | 終了通知書 | PI→CRB | ダウンロード |
| 別紙様式1 | 終了届書 | PI→地方厚生局 | ダウンロード |
《事務局》
| (CRB) | |||
| 統一書式 4 | 審査結果通知書 | CRB→PI | ダウンロード |
| 統一書式 13 | 認定臨床研究審査委員会の意見報告書 | CRB→地方厚生局 | ダウンロード |
| 参考書式 1 | 技術専門員評価書 | 技術専門員→CRB | ダウンロード |
| 参考書式 2 | 要件確認書 (I:研究責任医師・II:実施医療機関) |
(PI→CRB) | ダウンロード |
| 参考書式 3 | 技術専門員就任依頼書 | CRB→技術専門員 | ダウンロード |
| 参考書式 4 | 履歴書 | 研究者 | ダウンロード |






