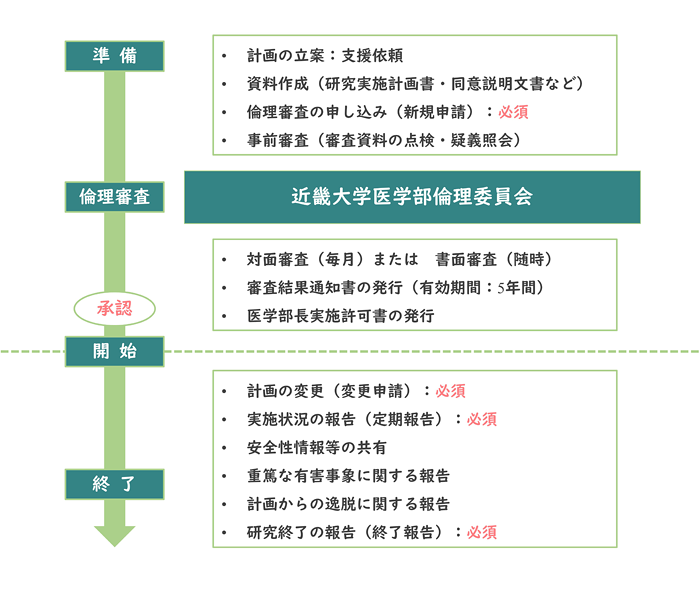
人を対象とした生命科学・医学系研究は、世界医師会による「ヘルシンキ宣言」、「人を対象とした生命科学・医学系研究に関する倫理指針」、個人情報の保護に関する法律等に従い、以下の流れで行われます。本学では、研究開始前に、倫理委員会において研究計画の科学的合理性、倫理的妥当性等に関する審査を受け、承認された場合に研究を開始することが可能となります。
本学の医師・研究者は、近畿大学病院内に設置された「Kindai Hospital Global Research Alliance Center(KHGRAC:カグラック)」で研究の立案・計画に関する相談を受けることができます。
詳しくは、こちらのウェブサイトをご確認ください。
ー 準備
以下の内容を十分ご理解いただいた上で、申請ごとに必要な書類を作成してください。
| 【臨床研究等を実施する医師・研究者の方へ】 | ダウンロード |
| 【人を対象とする生命科学・医学系研究の実施に係る標準業務手順書】 | ダウンロード |
| 【申請手順に関する説明】 | ダウンロード |
ー 新規申請
新たに倫理審査を申請する場合、以下のものが必要となります。
| 名称 | 備考 | |
| □ | 新規審査申請書(申請書) | 【近大-様式1】 |
| □ | 研究計画概要書(概要書) | 【近大-様式2】 |
| □ | 研究計画書(PRT) | 最新かつ版が分かるもの |
| □ | 同意説明文書(ICF) | 最新かつ版が分かるもの |
| □ | 同意書 | 特段の事情がある場合を除き、指定のものを使用 |
| □ | 利益相反(COI)に関する自己申告書 | 全研究者分をK-SHAREDからダウンロードして使用 |
| □ | 研究倫理に関する教育・研修終了症 | APRIN eラーニングプログラム(CITI Japan) |
| □ | その他、必要な資料 | ・他機関での倫理審査の承認書(写) ・研究で使用する医薬品・医療機器等の添付文書、等 |
ー 変更申請
研究計画の変更を申請する場合、以下のものが必要となります。
| 名称 | 備考 | |
| □ | 変更申請書 | 【近大-様式4】 |
| □ | 変更点一覧表(対比表) | 【近大-様式4】が複数ページとなる場合に作成 |
| □ | その他、必要な資料 | ・変更後PRT、変更後ICF ・変更後COI自己申告書 ・変更に関する他機関での倫理審査の承認書(写)等 |
ー 各種報告
実施中の研究に関する各種の報告を行う場合、以下のものが必要となります。
| 名称 | 備考 | |
| □ | 実施状況(進捗)報告書 | 【近大-様式5】 *目安は1年に1回程度 |
| □ | 研究終了(中止・中断)報告書 | 【近大-様式6】 |
| □ | 逸脱報告書 | 【近大-様式11】 |
倫理審査のお申込みは、必要な書類を添えて、下記まで必ず電子メールで提出してください。
内 線:3756
受付時間:AM 10:00~ PM 5:00 まで
(土曜・日曜・祝日、年末年始を除く)
メールアドレス:zizen@med.kindai.ac.jp
ー 事前審査
申請されたすべての研究を対象に学内委員で構成された「臨床研究事前審査委員会」において事前審査を行います。
事前事務局では、倫理指針等に基づき、下記の業務を行います。
(1)申請資料の点検
(2)申請内容に関する照会(「事務局意見」)
(3)審査方法の振り分け …「委員会審査(対面審査)」または「迅速審査(書面のみ)」のいずれか
事前審査が終了しましたら、申請者宛にEメールで事前審査結果報告書が送付されます。
ー 倫理委員会
事前審査の結果、「委員会審査」と判断されましたら、「医学部倫理委員会」において倫理審査を行います。
《開催形式》
2025年3月より「Web委員会」形式となりました。
《当日の流れ》
- 開始10分前に 事前審査事務局までお越しください。
(*事務局内に設置されたPCからWeb委員会にご参加いただきます) - 申請者より研究概要の説明(5分程度)
- 申請資料・事前審査結果報告書等に基づき、委員との質疑応答
- 申請者が退室(事務局横に待機スペースがございます)
- 委員会審議:「承認」・「不承認」・「変更の勧告」のいずれか
- 委員会終了後、後日、審査結果通知書が送付されます。
本学で臨床研究を行う医師・研究者は、研究の信頼性を確保するため、利益相反(COI)の有無、内容等に関する申告を行い、「近畿大学医学部利益相反マネジメント委員会(利益相反マネジメント委員会)」における審査を受ける必要があります。
必要な様式はK-SHAREDからダウンロードしてください。
| 名称 | 備考 | |
| □ | 【K-SHAREDから自己申告書をダウンロードする方法】 | ダウンロード |
| □ | 【利益相反自己申告書の提出方法について】 | ダウンロード |
| □ | 【医学部産学官連携活動に携わる教職員等の利益相反マネジメント実施要領】 | ダウンロード |
《注意》
- 臨床研究に関連しない、その他のCOI管理(例:国立研究開発法人日本医療研究開発機構(AMED)への申請にかかるCOI管理等)については、学術支援課へお問い合わせください。
- 臨床研究法に基づく特定臨床研究に関するCOI管理は、上記とは異なりますので、ご注意ください。
- 研究計画のCOIにかかる記載内容に変更が生じた場合は、変更申請が必要となりますが、その際、改めてCOIの自己申告も必要となります。
令和3年6月30日に施行された生命科学・医学系指針では、多機関共同研究にかかる研究計画書について、
原則として一つの倫理審査委員会による一括した審査が求められています。
本学では、従来の個別審査に加えて、一括した倫理審査を受けることが可能です。
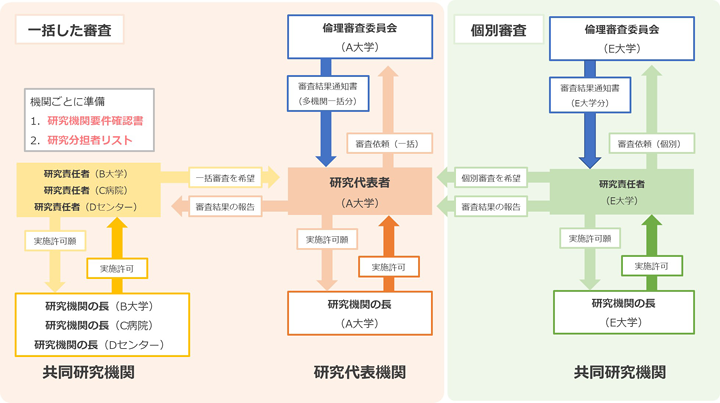
一括した審査を受ける研究に参加する場合、役割ごとに必要な様式が異なりますのでご注意ください。
| ① 研究代表機関(A大学に該当)を務め、本学倫理委員会に一括した審査を申し込む場合 |
| □ 様式1+2 □ A.研究者リスト(他機関所属を含む全研究者分) □ B.研究機関要件確認書(全研究機関分) □ 審査料(*有料審査となります) |
| ② 共同研究機関(B大学に該当)を務め、他の倫理委員会で一括した審査を受けた場合 |
| □ 様式12 □ 倫理審査結果通知書(*研究代表機関に送付を依頼してください) 注意:一括審査受審前に研究代表機関に提出する資料(一括審査依頼書、研究機関要件確認書、研究者リストなど)について事前事務局の確認を受けてください。 |
| ③ 共同研究機関(E大学に該当)を務め、本学倫理委員会に個別審査を申し込む場合 |
| □ 様式1+2 |
| いずれの場合でも必要な資料 |
| □ 研究実施計画書・同意説明文書・同意書 □ 利益相反自己申告書(本学の研究者分のみ) □ 研究倫理に関する教育研修証明(APRIN eラーニングプログラム修了証の写し等)など |
| 名称 | 備考 | ||
| □ | A:研究者リスト | 共同研究機関PI→本学PI→倫理委員会 | ダウンロード |
| □ | B:研究機関要件確認書 | 共同研究機関PI→本学PI→倫理委員会 | ダウンロード |
| □ | 「有料審査について」 | (令和6年1月23日付け通知) | ダウンロード |
《注意》
- 「一括した審査」と「個別審査」とを併せることが可能です(研究機関ごとの判断となります)。
- 審査料は、「有料審査について」内の表をご確認ください。
- 一括した審査にかかる手続きにお時間を要することがあります。事前に事務局までご連絡ください。
以下の様式は、医学系研究に関する法令・指針等の改訂に伴い、予告なく変更されることがあります。
常に最新版をダウンロードして使用するよう注意してください。
| 【最新版】一括ダウンロード | 2025/01/08更新 ( |
| 【様式1】新規審査申請書 | 2025/01/08更新 | y_01.docx |
| 【様式2】研究計画概要書 | 2025/01/08更新 | y_02.docx |
| 【様式3】変更の勧告に対する回答書 | 2025/01/08更新 | y_03.doc |
| 【様式4】変更申請書 | 2025/01/08更新 | y_04.doc |
| 【様式5】実施状況(進捗)報告書 | 2025/01/08更新 | y_05.doc |
| 【様式6】研究終了(中止・中断)報告書 | 2025/01/08更新 | y_06.doc |
| 【様式7】安全性情報等に関する報告書 | 2025/01/08更新 | y_07.doc |
| 【様式8】重篤な有害事象に関する報告書 | 2025/01/08更新 | y_08.doc |
| 【様式9】予期できない重篤な有害事象報告 | 2024/07/18更新 | y_09.doc |
| 【様式10】逸脱報告書(緊急の危険回避の場合) | 2025/01/08更新 | y_10.doc |
| 【様式11】逸脱報告書 | 2025/01/08更新 | y_11.doc |
| 【様式12】新規申請書(一括審査された多機関共同研究用) | 2025/01/08更新 | y_12.doc |
| 同意書 A3版 | 2024/10/30更新 | IC_A3.docx |
| 同意書 A4版(平易版) | 2024/10/30更新 | IC_A4.doc |
| 同意書の作成に関して | 2019/07/23更新 | ICW.pdf |
| 観察研究を実施する医師・研究者の方へ【STROBE声明(日本語訳)】 | 2022/09/09更新 | STROBE.pdf |
| 研究実施計画書(ひな形) | 2024/10/03更新 | PRT.docx |
| オプトアウト(ひな形) | 2024/07/18更新 | opt_out.docx |
| 臨床研究における外部監査の受け入れ手順について | sdv_tejun.pdf | |
| 【様式1】 原資料(カルテ)閲覧申込書 | 2023/09/12更新 | sdv_y1.xs |
| 【様式2】 直接閲覧実施に際して | 2023/09/12更新 | sdv_y2.doc |
| 【様式3】 原資料(カルテ)閲覧報告書 | 2023/09/12更新 | sdv_y3.doc |
| 【様式4】 監査実施依頼書 | 2023/09/12更新 | sdv_y4.doc |
ファイルのダウンロード方法とPDF文書の表示について
![]() Windows
Windows
ダウンロードしたいファイル名のリンク上で、マウスを右クリックすると、メニューが現れます。その中から「対象をファイルに保存」または「リンクを名前をつけて保存」を選んでください。
![]() Macintosh
Macintosh
ダウンロードしたいファイル名のリンク上で、マウスを押し続けると、メニューが現れます。その中から「リンクをディスクにダウンロード」または「リンクを別名で保存」を選んでください。